¿Qué es la Cinética Química?
Historia de la Cinética Química

Es la rama de la química que se
encarga del estudio de la rapidez de reacción, cómo cambia la rapidez de
reacción bajo condiciones variables.
Historia de la Cinética Química
- Destacan los trabajos de Wenzel; quien intentó medir la afinidad observando la velocidad con que los metales se disolvían en ácidos de distinta concentración.
- El nacimiento de la cinética química como disciplina científica se ubica en el año 1850, con Ludwig Wilhelmy.
- Estudios cinéticos de este tipo fueron realizados también por Berthelot y St Gilles.
- También pueden mencionarse los trabajos realizados en 1867 por A.V. Harcourt y W. Esson.
Conceptos
que se relacionan con la Cinética Química...
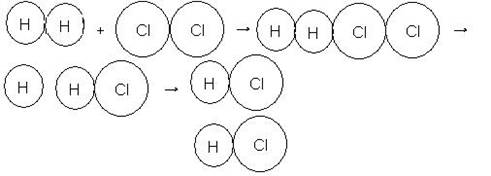
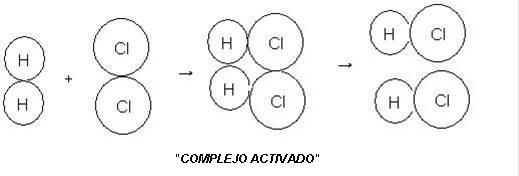
Teoría de las Colisiones:
La teoría de las colisiones fue propuesta por Max Trautz y William Lewis en
1916 y 1918.

Vertical –
Colisión más rápida, colisión efectiva
Energía de Activación:
La energía de activación es la energía que se requiere para que se inicie una reacción.
La energía de
activación suele utilizarse para denominar la energía mínima necesaria para que
se produzca una reacción
química dada. Para que ocurra una reacción entre dos
moléculas, éstas deben colisionar en la orientación correcta y poseer una
cantidad de energía mínima.
Orden de Reacción:
El orden de reacción está definido como la suma de los exponentes de las concentraciones en la ley de la rapidez de la reacción. Este es también llamado orden total de reacción, pues el orden depende del reactivo que se analice. El orden de la reacciones se determina experimentalmente.
- Nos sirve para poder monitorear el avance de reacción, los tiempos de reacción, los cambios de energía, los cambios de estado, etc. En teoría nos ayuda a lograr saber exactamente lo que está pasando en una reacción química.
- En farmacología puede ayudarnos para saber cuanto tiempo puede pasar para que un medicamento haga efecto.
- Sirve para poder calcular el tiempo de vencimiento de un producto químico industrial, farmacéutico, veterinario, alimenticio, etc.
Factores que afectan la velocidad de una reacción química...
- Las enzimas son moléculas de naturaleza protéica que catalizan reacciones bioquímicas, siempre que sean termodinámicamente posibles: Una enzima hace que una reacción química que es energéticamente posible, transcurra a mayor velocidad que sin la presencia de la enzima.
- Casi todos los procesos en las células necesitan enzimas para que ocurran a unas tasas significativas.
- A las reacciones mediadas por enzimas se las denomina reacciones enzimáticas.
- Debido a que las enzimas son extremadamente selectivas con sus sustratos y su velocidad crece sólo con algunas reacciones, el conjunto de enzimas sintetizadas en una célula determina el tipo de metabolismo que tendrá cada célula.
- Las enzimas funcionan disminuyendo la energía de activación de una reacción, de forma que se acelera sustancialmente la tasa de reacción.
- Las enzimas no alteran el balance energético de las reacciones en que intervienen, ni modifican, por lo tanto, el equilibrio de la reacción, pero consiguen acelerar el proceso incluso millones de veces. Una reacción que se produce bajo el control de una enzima, o de un catalizador en general, alcanza el equilibrio mucho más deprisa que la correspondiente reacción no catalizada.
- Las enzimas catalizan alrededor de 4.000 reacciones bioquímicas distintas.
- La actividad de las enzimas puede ser afectada por los inhibidores enzimáticos, que disminuyen o impiden la actividad de las enzimas.
 |
| Triosafosfato isomerasa |